La FDA encuentra problemas de contaminación en una planta de gotas para los ojos
MARTES, 4 de abril de 2023 (HealthDay News) -- Unos reguladores de EE. UU. que inspeccionaron una fábrica en India que se ha vinculado con unas gotas para los ojos contaminadas han descubierto una larga lista de problemas.
Un brote de infecciones oculares en que se implicaron productos fabricados en la planta surgió de la exposición a una bacteria altamente resistente a los medicamentos, conocida como Pseudomonas aeruginosa. Hasta ahora, tres personas han fallecido, mientras que ha habido ocho informes de pérdida de la visión y docenas de infecciones.
Los inspectores de la Administración de Alimentos y Medicamentos (FDA) de EE. UU. estuvieron en la fábrica de Global Pharma Healthcare Ltd. del 20 de febrero al 2 de marzo, donde identificaron equipo y ropas sucias, además de una falta de otras medidas de protección.
La FDA emitió notificaciones a la compañía tras lo que parece ser su primera visita a la planta.
"Usaron un proceso de fabricación que carecía de las garantías de esterilidad del producto", señaló la FDA en un documento de notificación.
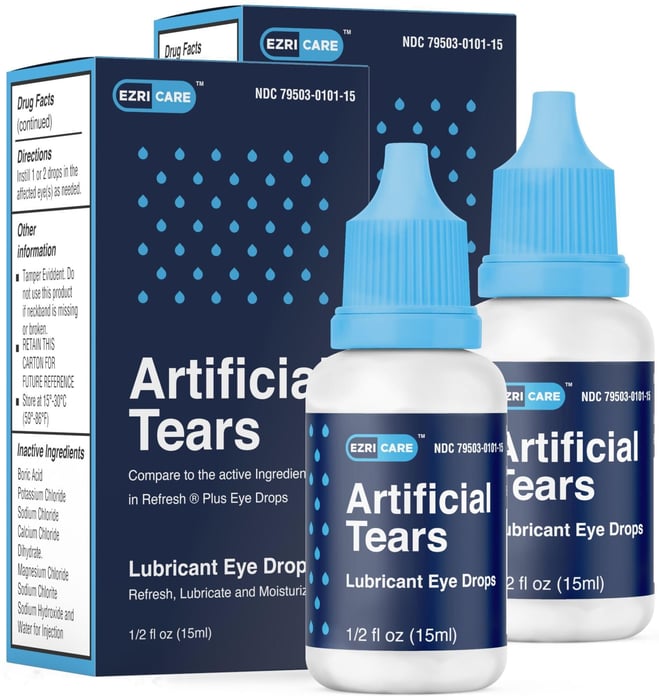
Las gotas de lágrimas artificiales y el ungüento implicados incluyeron a las marcas EzriCare y Delsam Pharma. Estos productos ya se han retirado.
Entre los muchos problemas identificados por la FDA se encontró que las superficies con que los paquetes de los productos entraban en contacto "no se limpiaban, desinfectaban, descontaminaban ni esterilizaban".
Una máquina usada para rellenar los frascos de producto tenían "un depósito grasiento negro y marrón" en una de las partes, aunque los registros de la compañía afirmaban que la máquina se había limpiado hacía semanas, y que no se había utilizado desde entonces.
Los registros sobre la limpieza de las máquinas de relleno y los espacios también presentaban lagunas y discrepancias, reportó CBS News.
Las superficies parecían ser difíciles de limpiar del todo. En un ejemplo, las paredes de una sala de relleno tenían "un sellador blando, que no era liso y que estaba agrietado, clavos que sobresalían y agujeros para clavos", según el informe.
Los inspectores encontraron botas para el uso en las zonas estériles de la compañía que estaban "descoloridas y desgastadas", y la compañía "no monitorizaba ni tenía estudios que mostraran cuántas veces" los trabajadores podían volver a reutilizar la ropa.
Aparentemente, la compañía tampoco realizaba unas pruebas importantes para garantizar que los productos fueran estériles u otras pruebas para determinar que los ingredientes suplidos a la compañía eran en realidad lo que se suponía que debían ser.
"Su firma no realizó ni una prueba para verificar la identidad de cada componente de un producto farmacológico. Su firma tampoco validó ni estableció la fiabilidad de los análisis de su suplidor de componentes a intervalos adecuados", escribieron los inspectores.
Algunas pruebas de las lágrimas artificiales sin abrir a principios del brote no encontraron bacteria, pero se encontró en los frascos que ya estaban abiertos. Pero, más adelante, la FDA "encontró tubos sin abrir contaminados con la bacteria", reportó CBS News.
La FDA no aclaró si la cepa de la bacteria que encontró era la misma que se observó en el brote.
Más información
Los Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU. ofrecen más información sobre la Pseudomonas aeruginosa.
Artículo por HealthDay, traducido por HolaDoctor.com
FUENTE: CBS News
Related Posts
HIV: What It Is, Causes, Diagnosis, Symptoms & Treatment
Even though HIV is just one of a vast number of viruses that infect people,...
Overall Increase Seen in COVID-19 Vaccine Acceptance Globally
WEDNESDAY, Jan. 11, 2023 (HealthDay News) -- COVID-19 vaccine acceptance has...
Youngest Kids in Class More Likely to Get Prescribed ADHD Meds
FRIDAY, Dec. 16, 2022 (HealthDay News) -- Kids who are the youngest in their...
La Casa Blanca actúa para que las pastillas antivirales contra la COVID estén más disponibles
MARTES, 26 de abril de 2022 (HealthDay News) -- La administración de Biden...
